Básicamente lo que hizo Joule para encontrar el equivalente mecánico del calor fue construir un experimento como el que se puede ver en el vídeo en el que podía fácilmente calcular el trabajo realizado por los pesos que vemos a ambos lados al bajar una cierta distancia y medir el grado en el que aumenta la temperatura en el líquido contenido en el recipiente central a consecuencia del calor generado por las aspas giratorias accionadas por los pesos.
domingo, 11 de diciembre de 2016
domingo, 4 de diciembre de 2016
POR QUÉ HIBRIDACIÓN sp3 EN LA MOLÉCULA DE AGUA
Para justificar la disposición angular de 104'5 º que se mide experimentalmente de la molécula de agua tenemos que recurrir irremediablemente a la hibridación del oxígeno.
viernes, 2 de diciembre de 2016
HIBRIDACIÓN sp2 CON ENLACE DOBLE
Cuando se produce hibridación sp2 queda un orbital p sin hibridar que será el responsable del enlace pi molecular. Los tres orbitales sp2 se distribuirán sobre un mismo plano con de de alejarse lo más posible los unos de los otros, al repelerse.
HIBRIDACIÓN sp CON ENLACES TRIPLES - Etino
Los enlaces triples se deberán siempre a la combinación de un enlace sigma (solapación frontal) con dos enlaces pi (entre orbitales paralelos). En el caso del etino, el enlace sigma entre los dos carbonos se producirá entre un orbital sp de cada uno. El otro orbital sp enlazará con un hidrógeno. Los orbitales no hibridados py y pz de cada átomo serán los responsables de los dos enlaces pi.
GEOMETRÍA MOLECULAR CON ENLACE COVALENTE (TRPECV).
La TRPECV (Teoría de Repulsión de los Pares Electrónicos de la Capa de Valencia) da una pauta o criterio para figurarse la geometría de una molécula en función del número de pares de electrones (tanto enlazantes como no enlazantes), donde los enlaces dobles o triples también cuentan como uno.
viernes, 25 de noviembre de 2016
ENLACES SIGMA Y PI. HIBRIDACIÓN Y ORBITAL MOLECULAR.
Este vídeo muestra de forma maravillosa como se forma los tres tipos de hibridación posibles, por fusión de un orbital s con tres p (sp3), uno s con dos p (sp2) o uno s con uno p, para dar lugar a orbitales híbridos que, en realidad, al enlazar, se funden con el orbital del otro átomo para que se constituya un orbital molecular.
martes, 8 de noviembre de 2016
O3: OZONO
La molécula de ozono tiene una estructura resonante basada en la oscilación entre las dos posibilidades de enlazas sus tres átomos de oxígeno con un enlace doble y otro simple para que cada uno de ellos satisfaga la regla del octeto.
viernes, 14 de octubre de 2016
METANO
El metano, CH4, es el más sencillo posible de los compuestos de Química Orgánica. Pertenece al grupo de los alcanos. aquellos compuestos orgánicos que solamente establecen enlaces simples entre sus átomos. Además, tal y como se explica de forma muy pedagógica en el vídeo, se dispone en una forma tetraédrica totalmente simétrica debido a la repulsión mutua entre los electrones de los hidrógenos, lo cual lleva encontrar la forma en el espacio de alejarse lo más posible unos de otros: formando un ángulo entre ellos de 109'5 º.
jueves, 13 de octubre de 2016
DESCUBRIMIENTO DEL NEUTRÓN
El neutrón no fue descubierto experimentalmente hasta el año 1932 y es que el hecho de que fuera una partícula neutra dificultaba enormemente su detección. De hecho, como se puede observar el el vídeo, solamente su detección indirecta es posible.
Los indicios sobre su posible existencia venían de la evidencia de que la masa de los átomos de helio era unas 4 veces mayor a las de hidrógeno cuando se sabía que el helio tenía dos protones y el hidrógeno uno (por lo que era de esperar una masa doble). En realidad, Marie Curie ya había evidenciado la existencia de partículas neutras con masa en sus estudios de la radioactividad.
En el experimento realizado por James Chadwick se utilizó una fuente radioactiva de polonio para emitir partículas alfa que al impactar contra una lámina de berilio emitían un segundo tipo de radiación que no se podía detectar directamente (los neutrones).
La forma de constatar este segundo tipo de radiación era colocando una segunda lámina (en este caso, de parafina) como obstáculo en su recorrido. Lo que se observaba es que como resultado de las colisiones de estas partículas "transparentes" con la parafina se emitían otras partículas que ahora sí estaban cargadas, de cuya dispersión en una cámara de gas y la corriente generada en un cátodo se podían deducir sus propiedades, apuntando a que eran protones.
Trazando inferidas las propiedades de los protones con las que tenían que tener las partículas colisionantes (aplicando conservación de la energía y el momento lineal) se dedujo que tales partículas debían de ser neutras y poseer una masa muy parecida a la del protón. Se había descubierto el neutrón.
lunes, 10 de octubre de 2016
BENZENO
El benceno fue aislado químicamente por primera vez por Micheal Faraday. Aunque su fórmula empírica, C6H6, no se pudo establecer hasta que Mitscherlich consiguió medir su masa molecular. Aún mucho más difícil fue dilucidar su estructura espacial. Varios científicos propusieron diferentes modelos fallidos al no encajar bien con las propiedades que se medían según era de esperar, hasta que Kekulé dio con la bella forma del benceno: un anillo hexagonal con tres dobles enlaces que entran en resonancia entre sus dos posibles configuraciones. La leyenda cuenta que Kekulé adivino la forma correcta del benceno tras aparecérsele en un sueño una serpiente que se mordía la cola cerrándose en círculo.
sábado, 8 de octubre de 2016
CARBONO
El carbono es un átomo crucial para el establecimiento, desarrollo y mantenimiento de la vida en nuestro planeta. Y todo parece que radica en un complejidad 'exactamente' intermedia. Ni tan simple como el hidrógeno, el cual solamente posee un electrón. Ni completo como un gas noble, el cual posee ocho electrones en su capa de valencia. El carbono, por contra, posee cuatro electrones en su capa de valencia (la mitad de los necesarios para ser 'completo'), que más los dos que tiene en su capa más interna, le confieren un total de seis electrones.
Esa equidistancia entre el todo y la nada en cuanto al número de electrones de su capa de valencia (cuyo nivel cuántico se corresponde con n = 2) y el hecho de ser el átomo más pequeño en cumplir esa propiedad (los otros se corresponden con niveles dados por n = 3, 4, 5,...; silicio, germanio, estaño, plomo,...) es lo que parece que lo distingue sobre todos los demás elementos químicos. ¿Por qué?
Si le faltaran o sobraran uno, dos o tres electrones para ser completos, le bastaría con asociarse con respectivamente uno, dos o tres átomos (más o menos dependiendo de que los enlaces sean simples, dobles o triples). Pero por su carácter tetravalente (puntualmente puede ser también bivalente si lo que hace es ceder los dos electrones en los orbitales p) el número de átomos con los que se suele rodear es máximo y su número es cuatro. Cuando los átomos con los que buscan compartir electrones para completarse son los de hidrógeno da lugar a los hidrocarburos. La simplicidad del hidrógeno combinada con la tetravalencia del carbono da lugar a una plasticidad que se manifiesta por la enorme cantidad de posibles moléculas que se pueden constituir a partir de ellos, más de 500.000 compuestos de formas, tamaños y funciones increíblemente variados, los cuales, con pequeñas modificaciones aceptan otros átomos (oxígeno, nitrógeno y fósforo principalmente) para construir las moléculas de la vida (proteínas, ácidos nucléicos, ADN, ARN).
La electrostática y la geometría se confabulan en el carbono. ¿Cómo? De forma natural, su carácter tetravalente adopta la forma, a través de la constitución de cuatro orbitales híbridos moleculares, de un tetraedro. Los orbitales híbridos (sp3) aparecen cuando el carbono "se prepara" para enlazar, al traspasar uno de los dos electrones de su orbital 2s al orbital libre 2p (véase el vídeo de arriba) y conseguir transformarse en una nueva forma en la que adquiere una distribución simétrica propiciada por la repulsión mutua de todos los cuatro electrones exteriores. Esta geometría es la que subyace a algunas de las formas en las que encontramos al carbono en la naturaleza, sólidos basados en una celda unitaria de estructura hexagonal o cúbica (como en el caso del diamante). En otros casos lo encontramos en compuestos inorgánicos como la piedra caliza, cuyo principal contenido es carbonato de calcio.
PRINCIPIO DE EXCLUSIÓN DE PAULI, ORBITALES Y ESTRUCTURA ELECTRÓNICA.
El principio de exclusión de Pauli nos dice que en un átomo no pueden existir dos electrones con los mismos valores para los cuatro números cuánticos: n, l, ml y ms.
El principio de mínima energía nos indica que los electrones tienden a ocupar los niveles cuánticos libres (a tenor del principio de exclusión de Pauli) con la menor energía posible, para la cual tienen una mayor estabilidad.
Conforme se estudian los átomos de los elementos de la tabla periódica con mayor número de electrones, la energía de cada una de ellos se ve afectada no solamente por la atracción eléctrica del núcleo, sino también por la repulsión ejercida por los demás electrones. Esto lleva a que la valoración energética de cada nivel correspondiente a los cuatro números cuánticos posible no sea nada evidente.
Bajo la consideración anterior se establece el orden por el que rellenan los orbitales atómica en función de lo que se conoce como la estructura electrónica de cada elemento químico.
MODELO ATÓMICO DE SOMMERFELD
El modelo atómico de Sommerfeld surge de considerar velocidades relativistas para los electrones y la posibilidad de órbitas elípticas para poder explicar la aparición de líneas espectrales que se desdoblan para un mismo nivel energético al considerar elementos de la tabla periódica otros que el hidrógeno.
domingo, 2 de octubre de 2016
LÍNEAS ESPECTRALES DEL ÁTOMO DE HIDRÓGENO
Poco tiempo después de observar la serie espectral de Balmer se observaron también las series de Lymann, Bracket, Paschen y Pfund, cuya diferencia esencial era en nivel energético atómico de procedencia en las transiciones de los electrones que provocaban la emisión de un fotón (n = 1, 3, 4, y 5 respectivamentE).
Todas estas lineas espectrales incluida la serie de Balmer podían ser explicadas por la siguiente fórmula empírica, conocida como fórmula de Rydberg.
SERIE DE BALMER
El análisis de las lineas espectrales de emisión del hidrógeno obtenidas al calentar el mismo por alto voltaje y separadas por mediación de un prisma llevó a la definición de una fórmula empírica que se conoce como serie de Balmer y que hoy en día sabemos que se corresponde con la luz emitida al saltar un electrón desde cualquier nivel energético con n > 2 al nivel correspondiente a n = 2.
Este espectro puede ser observado con instrumentos ópticos convencionales porque su longitud de onda cae dentro del visible.
Tanto el espectro correspondiente a la serie de Balmer como las otras lineas espectrales que se descubrieron más adelante pudieron ser cuadradas por la fórmula empírica de Rydberg.
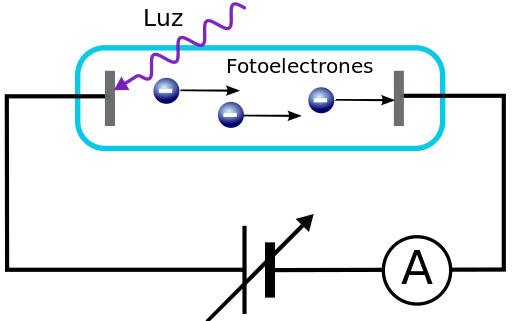
EL EFECTO FOTOELÉCTRICO
En el año 1905 el efecto fotoeléctrico volvió a romper los esquemas de las físicos después de que Planck hubiera encontrado la forma de encajar el espectro de radiación de un cuerpo negro bajo la hipótesis de la cuantización de la energía de la luz.
El efecto fotoeléctrico no hizo sino confirmar esta tesis así como el hecho de que la luz estuvieran constituida por partículas: los fotones.
Sólo así se podía explicar que la corriente eléctrica generada dependiera de la frecuencia de la luz incidente más que de su intensidad, por encima del trabajo de extracción necesario para arrancar el electrón de la materia, cuyo valor depende el material.
LEY DE PLANCK
Max Planck hizo una chocante suposición, probablemente basándose sólo en argumentos matemáticos, para intentar encajar el espectro de emisión de un cuerpo negro que se registraba experimentalmente: la energía de las partículas responsables de la emisión se tenía que distribuir en paquetes discretos de energía múltiplos naturales de la frecuencia con que se emitían.
La consecuencia de esta suposición es que ahora para calcular el valor medio de las partículas en lugar de resolver una integral (como deber ser el caso cuando la energía se supone que se distribuye de forma continua) lo que hay que calcular es una sumatorio cuya expresión final se deduce aplicando las fórmulas de las series geométricas.
La fórmula que se obtiene ahora si que concuerda completamente con el espectro registrado y además se confirmaría con dos leyes más relacionadas con éste:
- la Ley de Wien.
- la Ley de Stephen-Boltzmann.
LOS MODELOS ATÓMICOS DE DALTON, THOMSON, RUTHERFORD Y BOHR
Una de las primeras personas en considerar que la materia debía estar compuesta por átomos fue Dalton al evidenciarse que en la formación de compuestos químicos siempre se mantenían ciertas proporciones entre los elementos involucrados, lo cual solamente se podía explicar considerando una estructura subyacente (aunque anteriormente ya Lomonosov había imaginado la materia constituida por átomos que se combinaban formando moléculas).
El descubrimiento del electrón conllevó la formulación del modelo atómico de Thomson conocido como pudding de pasas, en el que los átomos estarían constituidos por una carga positiva ocupando todo el volumen en el que estarían insertadas las cargas eléctricas negativas.
El experimento de Rutherford puso de manifiesto por primera vez que el átomo está esencialmente vacío y concentra toda su carga positiva en un diminuto núcleo atómico. Los electrones estarían orbitando alrededor cómo ocurren con los planetas alrededor del Sol. Sin embargo, atendiendo a la presunción de que el electrón tendría que emitir radiación electromagnética, no se podía explicar por qué no colapsaba contra el núcleo por ir reduciendo paulatinamente su radio orbital según iba irradiando energía.
El modelo de Bohr fue el primero en proponer una solución en el marco de la naciente Física Cuántica en aras de la asunción del principio de la primera cuantización, tal y como se verá más adelante.
EL EXPERIMENTO DE RUTHERFORD
Ernest Rutherford dirigió un experimento que se realizó en 1909 y cuyos resultados se publicaron en 1911 y que cambió radicalmente la visión del átomo que se tenía hasta entonces.
El experimento consistía en hacer pasar a través de una lámina de oro un haz de partículas alfa que se generaban a partir de una fuente radioactiva de polonio y se dejaban salir a través de dos agujeros alineados de forma que se asegurara que el haz era recto.
Lo que se observó es que a pesar de que la gran mayoría de las partículas atravesaban la lámina sin desviarse tal como predecía el modelo de Thomson imperante en la época, unas pocas resultaron desviarse dejando un impacto en la pantalla circular dispuesta alrededor en incluso algunas (aproximadamente 1 de cada 20.000) "rebotaban" siendo desviadas hacia atrás.
Esto sugería una nueva concepción del átomo, en la que toda la carga positiva se concentraba en el núcleo central y los electrones orbitaban alrededor, de forma que la casi totalidad del espacio considerado estaba vacío.
La reconstrucción del proceso cinemático de los eventos a partir de las muestras del los impactos registrados permitió obtener un valor empírico de la sección eficaz de los mismo, lo que viene a ser la extensión alrededor de los núcleos hasta donde interactúan con las partículas incidentes, con lo que se estimó que el radio de núcleo atómico era del orden de 10-10m (mientras el núcleo tenía un radio del orden de 10-14m).
sábado, 1 de octubre de 2016
DESCUBRIMIENTO DEL PROTÓN
Eugen Goldstein tuvo la ocurrencia de realizar unos agujeros en el cátodo de un tubo de rayos catódicos. Lo que observó es que cuando aplicaba el alto voltaje además de la luz característica debida a la emisión de los rayos catódicos (electrones), aparecía otro haz luminoso de otro color detrás del cátodo. A estos rayos se los denominó rayos canales y fueron observados por primera vez en el año 1886.
Poco tiempo después Wilheim Wien, demostró que estos rayos eran debidos a partículas de carga positiva al ver que al aplicar un campo eléctrico perpendicular a su trayectoria, ésta se curvaba hacia el polo negativo que lo generaba. En función de la desviación vertical sufrida por los rayos canales en el fondo del tubo se podía deducir la relación entre la carga y la masa (e/m). Suponiendo que la carga era idéntica que la del electrón pero cambiada de signo, se observó que la masa estaba en correspondencia con la masa atómica del elemento que ocupaba el gas.
Se había descubierto el protón y se había confeccionado el mecanismo que derivaría en la espectroscopia de masas. La masa hallada cuando el gas utilizado era hidrógeno era 1840 veces mayor a la masa del electrón. Aunque el hallazgo no fue corroborado hasta el año 1919 cuando Rutherford encontró trazas de núcleos de hidrógeno al bombardear con partículas alfa un gas de nitrógeno.
En el vídeo de abajo se puede ver como los rayos canales se producen por la ionización de las átomos de gas al chocar con los electrones que constituyen los rayos catódicos.
DESCUBRIMIENTO HISTÓRICO DEL ELECTRÓN
El crucial descubrimiento del electrón fue el producto de décadas de investigación experimental y pequeñas contribuciones de muchas personas. Pero la autoría del mismo se la atribuye específicamente a J.J.Thomson, quien supo rellenar los huecos que los anteriores experimentos habían dejado, perfeccionarlos y combinarlos adecuadamente para sacar conclusiones claras.
El dispositivo experimental que utilizó fue el tubo de rayos catódicos (CRT). Con diferentes experimentos realizados sobre la base del CRT se definieron la propiedades de los rayos catódicos. Una de las más importantes es que no importa cual sea el material del que esté formado el cátodo, los rayos tienen exactamente el mismo comportamiento. Por lo tanto deben de estar relacionados con algún tipo de componente elemental de la materia, pues es idéntico y está presente en todos los materiales.
El experimento de Thomson más relevante fue sin duda es que aportó como resultado la medida la relación entre la carga eléctrica y la masa del electrón: e/m. Su estrategia para obtener este valor fue la de relacionar el campo eléctrico con el campo magnético para el que se obtenía la misma deflexión vertical.
Hoy en día hay experimentos más sofisticados que permiten obtener esa misma medida de forma más clara utilizando unas bobinas de Helmholtz que permiten crear un campo magnético tan potente que la trayectoria del rayo catódico se curva hasta encerrarse en un círculo. En ese caso, la posibilidad de utilizar el radio medido del círculo simplifica enormemente el cálculo.
DEFLEXIÓN VERTICAL EN UN TUBO DE RAYOS CATÓDICOS
Una de las propiedades más útiles de los rayos catódicos es de la curvarse a pasar a través de un campo eléctrico. El campo eléctrico puede crearse sometiendo dos placas conductoras paralelas a un cierto voltaje en el interior del tubo de rayos catódicos. Como producto de la fuerza eléctrica actuando sobre las partículas cargadas los rayos catódicos desviarán su trayectoria, lo que se traducirá en que su proyección en la pantalla final (ánodo) sufrirá una deflexión vertical con respecto a su posición original.
Un estudio pormenorizado, que tenga en cuenta los voltajes concretos que se apliquen entre el ánodo y el cátodo y en las placas que curvan la trayectoria de los rayos, así como la posición, orientación y tamaño exacto de todos los elementos constituyentes incluyendo el propio tubo, permiten obtener la expresión matemática exacta de la deflexión vertical (y) que se espera.
Este estudio requiere unos conocimientos previos básicos de:
- geometría
- conservación de la energía: para hallar la velocidad de partida de los rayos a sabiendas que toda la energía cinética (1/2·m·v^2) que obtienen debe provenir de toda las energía eléctrica que se acumula en el cátodo (e·V)
- vectores: para saber descomponer la trayectoria en sus dos componentes horizontal y vertical y operar con ellas por separado
- cinemática: para calcular tiempos y desplazamientos en cada eje según la velocidad inicial y eventualmente la aceleración (vertical, que entre las placas se debe a la fuerza eléctrica que generan sobre los rayos)
Así, aplicando las reglas de conservación de la energía y dividiendo el problema en fragmentos más pequeños donde se pueden aplicar las reglas de la cinemática, se obtiene que la deflexión vertical total solamente depende de dos cosas:
- la geometría del tubo de rayos catódicos, la cual, para cada modelo particular, puede ser reducida a una constante
- el cociente entre el voltaje aplicado entre las placas centrales encargadas de producir la deflexión y el voltaje aplicado entre el ánodo y el cátodo encargado de producir los rayos
El hecho de que la deflexión sea directamente proporcional al voltaje aplicado entre las placas centrales convierte al tubo de rayos catódicos en elemento principal para dos de los aparatos más utilizados por nuestra sociedad actual:
- el osciloscopio
- la televisión
Sin embargo es importante destacar que la deflexión vertical de los rayos catódicos debida a la aplicación de un campo eléctrico externo en parte de su trayectoria no depende en absoluto ni de la masa ni de la carga de las partículas asociadas a estos rayos.
PROPIEDADES DE LOS RAYOS CATÓDICOS
Con la ayuda de ciertos utensilios se pueden hacer pequeños experimentos con un tubo de rayos catódicos y obtener las principales propiedades de los rayos catódicos:
- Los rayos catódicos surgen del cátodo y se propagan en línea recta (si no hay campos eléctricos y/o magnéticos en su trayectoria).
- Deben de tener masa, ya que son capaces de hacer mover las aspas de un molinete al transmitirle su energía cinética.
- Deben de tener carga eléctrica ya que son curvados en presencia de un campo magnético.
- Igualmente si atraviesan una zona con un campo eléctrico son curvados produciéndose una deflexión.
- Pueden convertir su energía cinética en térmica aumentando la temperatura de los cuerpos con los que impactan.
sábado, 24 de septiembre de 2016
RAYOS CATÓDICOS
El tubo de rayos catódicos surge como una mejora del tubo de Crookes, poniendo de manifiesto unos rayos lumínicos que aparecen cuando se aplica un alto voltaje entre sus dos electrodos. Colocando una cruz de Malta en su interior de un material duro que no puede ser atravesado por la luz ni la materia y observando donde se proyecta su sombra, se llega a la conclusión de que los rayos provienen del cátodo. De ahí su nombre.
También se comprueba que estos rayos se ven atraídos por un imán, lo cual no ocurre con los rayos de luz ordinarios. La primera evidencia experimental de este hecho fue presentada en el año 1858 por Julius Plücker tras estudiar el efecto de un electroimán sobre la descarga eléctrica en tubos de vacío (usando lo que hoy se conocen como tubos de Geissler) conteniendo gases enrarecidos. Por lo que deben tener carga eléctrica asociada. Dado que surgen del cátodo, el polo negativo, es de esperar que su carga sea negativa también. Pero para confirmar su carga negativa lo que se hizo fue colocar unas placas conductoras paralelas entre sí, a medio recorrido dentro del tubo, y observar hacia donde y con qué grado de deflexión se curvaban los rayos si se aplicaba un voltaje dado a éstas.
Suscribirse a:
Comentarios (Atom)